В этом нет ничего удивительного. Раковая клетка — это такая же клетка организма, как и все остальные. В ней тот же набор генов. Все, что с ней происходит в процессе ее постепенного перерождения — генетические нарушения (мутации), изменения регуляции работы генов, и прочее — все это присуще и здоровой клетке. Важное событие в этом ряду — снятие блоков с группы генов, которые обеспечивали интенсивное деление клеток в эмбриогенезе. Поэтому раковая клетка постоянно готова к делению. Только, в отличие от эмбриональной клетки, она неспособна воспринимать регулирующие сигналы организма. В результате возникает злокачественная опухоль — клон потомков той единственной клетки, в которой фатальным образом совпали мутации, дающие ей возможность размножаться и паразитировать в организме, избегая действия всех контролирующих механизмов.
Чтобы вылечить рак, нужно использовать биологические методы
Тератогенные или эмбриотоксические вещества могут попасть в кровь беременной женщины из пищи, лекарств или воздуха. Их дальнейший путь зависит от многих факторов. Судя по конечному результату — поражению клеток эмбриона — они обладают какими-то преимуществами перед другими молекулами. Одно из этих очевидных преимуществ — это способность проходить через плаценту, которая разделяет кровь матери и плода. Далеко не все вещества способны самостоятельно преодолеть этот барьер, состоящий из нескольких слоев клеток. Для жизненно-важных молекул, например, омега-3 полиненасыщенных жирных кислот, известен специальный белок-переносчик: альфа-фетопротеин или АФП, который захватывает эти молекулы в свой пространственный «гидрофобный карман» и целенаправленно проносит внутрь клетки.
Этот белок иногда называют эмбриональным альбумином, так как он выполняет транспортные функции, аналогичные тем, что выполняет альбумин в крови взрослого человека. Считается, что некоторые тератогены связываются с АФП и таким образом попадают в кровь и клетки эмбриона.
Это предположение легло в основу множества научных разработок, нацеленных на создание способов «адресной» доставки веществ в заданную клетку. Дело в том, что проникновение АФП в клетку — это строго регулируемый процесс, осуществляемый через специальные АФП-рецепторы на поверхности клетки. После высвобождения агента, АФП целым и невредимым выходит обратно в кровь и может совершать повторные транспортные рейсы. То есть «троянский конь» АФП работает как челнок. Об особой важности этого белка в эмбриогенезе свидетельствует тот факт, что в процессе развития и дифференциации эмбриональных клеток транспортная система АФП и его рецептор появляются раньше всех. Вскоре после рождения этот белок и рецепторы к нему исчезают. Природа предусмотрела блокирование их генов у взрослого организма.
Большинство раковых клеток имеют на своей поверхности АФП-рецепторы
Как было отмечено, раковые клетки ничего не «изобретают», они используют тот же генетический материал, который содержится в каждой клетке с момента зачатия. Этот генетический материал они применяют очень эффективно, в том числе используют повторно (реэкспрессируют). То есть в результате «канцерогенного» воздействия возникают мутации, снимаются блоки с генов АФП и его рецепторов (и с ряда других эмбриональных белков). В этом и есть уязвимое место раковых клеток: они задействуют те же системы регуляции и доставки питательных веществ, что и эмбриональные клетки. Это явление широко используется в современной медицине в качестве раннего диагностического признака: если во взрослом организме вновь появляются эмбриональные белки и/или рецепторы к ним, значит где-то зреет раковая опухоль!
Рецепторы к эмбриональным белкам, известные в медицине как онкомаркеры, используются раковыми клетками отнюдь не для удобства диагностики, а с целью улучшения питания и регуляции роста раковых клеток. Раковые клетки могут иметь повышенное число рецепторов к трансферрину, эпидермальному фактору роста и другим веществам, характерным для эмбриональной или растущей клетки. Однако максимальное количество — до 90 % — всех раковых клеток реэкспрессируют рецептор к АФП. Среди 60 клеточных линий раковых клеток, используемых в Национальном институте рака США для тестирования потенциальных лекарств, лишь несколько линий было без АФП-рецепторов. Сравнительно недавно открытые стволовые раковые клетки, которые считают рассадником метастазов, с большой долей вероятности имеют рецепторы к АФП.
Используя АФП для доставки тератогена, можно избирательно уничтожать раковые клетки
Нормальные взрослые клетки организма практически не содержат АФП-рецептор, что обеспечивает лечение рака комплексами АФП+тератоген практически без побочных эффектов — лекарственный комплекс в них просто не попадет. Почему тератогены привлекли наше внимание? Дело в том, что их немного, и они сравнительно хорошо изучены. Известно около 600 тератогенов, что значительно меньше многомиллионных библиотек химических веществ, которые тестируются в научных лабораториях всего мира в надежде найти средства против рака. Для многих тератогенов известны важные для нашей цели параметры: их способность связываться с АФП, и их внутриклеточные мишени. Оказалось, что самые сильные тератогены поражают мишени, которые задействованы в процессе апоптоза — программированной клеточной гибели. Благодаря апоптозу у человека каждый день «рассасываются» десятки миллиардов отработавших клеток (а это несколько грамм клеток!), на смену которым приходят молодые. При апоптозе в клетках происходит самопереваривание внутриклеточного материала и распределение его между соседними здоровыми клетками. Этот процесс осуществляется без образования токсических метаболитов. Таким образом, основная задача онкологии — избирательно убирать «плохие» и не повредить здоровые клетки организма — уже решена в природе. Надо лишь «починить» механизм апоптоза в раковых клетках.Основные методы, которые используются медициной в настоящее время: хирургия, облучение и химиотерапия — неспособны полностью решить проблему рака, так как они не опираются на современные представления о механизмах функционирования раковой клетки.
Биологические методы — это необходимая часть комплексной терапии рака
Здоровье многоклеточного организма поддерживается многими системами, из которых в качестве противораковых выделим две: апоптоз на уровне клетки и иммунитет на уровне организма. Вместе они работают достаточно слаженно, так как большинство из нас раком не болеет. Диагноз «рак» означает: обе системы отказали. В клетках рака молочной железы насчитывают 150-200 мутаций по сравнению с нормальными клетками, но важнейшие из них 7-10 — это те, которые лишили клетку апоптоза — способности совершить акт самоубийства, распознав свою опасность для организма. Чтобы победить рак, необходимо в первую очередь преодолеть действие именно этих мутаций и «включить» апоптоз.
Традиционные химиопрепараты-цитостатики (фторурацил, доксорубицин, соединения платины, паклитаксел и др.) подавляют деление клетки. В дальнейшем поврежденная цитостатиком клетка либо погибает и лопается (некроз), выбрасывая в кровь кучу «мусора», либо физиологично самопереваривается с помощью апоптоза, без повреждения клеточной мембраны. Понятно, что второй путь предпочтительнее. Однако на практике, при применении препаратов, блокирующих деление, первыми погибают здоровые клетки с исправной системой апоптоза. Это растущие клетки системы кроветворения, иммунитета, слизистой кишечника, волосяной луковицы и др. Отсюда и множественные побочные эффекты от применения цитостатиков. При этом многие раковые клетки выживают, так как в них повреждена система апоптоза. Они дают потомство, устойчивое сразу ко многим химиопрепаратам. Поэтому повторные курсы химиотерапии менее эффективны, чем первый, при сохранении тех же токсических последствий для онкобольного.
Применение комплексов АФП+тератоген является перспективным методом противораковой терапии
В любой клетке организма исполнители апоптоза находятся наготове и ждут сигнала. Однако мутации в раковых клетках приводят к тому, что эти сигналы не проходят. Например, основной белок контроля апоптоза — р53 — неактивен в 50 % случаев рака. Из этого следует, что разумная стратегия противораковой терапии должна активировать апоптоз в раковых клетках, а не подавлять деление клетки, как это делают традиционные химиопрепараты.
Для описания механизма действия препаратов, индуцирующих или активирующих апоптоз, поясним роль клеточных мембран.
При катастрофической гибели клетки — некрозе — разрушается клеточная мембрана. В случае ее повреждения все содержимое клетки попадает в кровь, что ведет к воспалительным, иммунным реакциям, токсикозу и другим последствиям некроза.
При апоптозе клеточная мембрана остается целой, зато разрушаются мембраны внутриклеточных органелл, например, митохондрии. К препаратам-разрушителям мембран не существует лекарственной устойчивости. Мембрана — это граница между жизнью и смертью. Нарушение целостности любой из мембран органелл — процесс необратимый и влечет за собой гибель всей клетки посредством апоптоза. Не зря митохондрию считают «точкой возврата» на внутреннем пути апоптоза. Помимо митохондрий в процесс апоптоза могут быть вовлечены и другие органеллы и структуры: внутриклеточный эндоплазматический ретикулум; лизосомы — внутриклеточные «желудочки» (их еще называют «мешком самоубийства» клетки из-за содержащихся там гидролитических ферментов).
Мембраны внутриклеточных органелл по своим физико-химическим свойствам похожи на мембраны бактериальной клетки. И если в борьбе с бактериальными заболеваниями человечество успешно применяет вещества, разрушающие мембрану бактерии (ионофоры, мыла, антибиотики), то те же самые вещества можно применить и для разрушения мембран органелл раковой клетки. Далее неизбежно включится система самоуничтожения клетки. Проблема только в том, как доставить эти вещества (назовем их «индукторы апоптоза») внутрь этой самой клетки. Вот тут-то и пригодится АФП, который может захватить эти вещества и внести их внутрь клетки.
В поиске тератогенов, наиболее перспективных в противораковой терапии, мы обращали особое внимание на те из них, для которых показана способность разрушать мембраны. Среди изученных тератогенов оказалось немало таких, которые могут разрушать мембраны митохондрий. Все эти вещества чрезвычайно токсичны для живой клетки. Однако, если они надежно спрятаны в гидрофобном кармане АФП, то они безвредны для организма до тех пор, пока этот белок не внесет их внутрь раковой клетки и не освободит их там. Таким образом, для апоптоза раковых клеток эти вещества являются оптимальными.
АФП+индукторы апоптоза могут применяться как самостоятельно, так и для повышения эффективности химиотерапии
Совместное применение индукторов апоптоза и химиотерапии имеет ряд преимуществ. Например, с их помощью можно преодолеть феномен так называемой «лекарственной устойчивости» раковых клеток к химиотерапии. Индуктор апоптоза уничтожит те клетки, которые оказались нечувствительными к воздействию химиопрепарата. Общий эффект оказывается выше.
Еще одним плюсом применения АФП в составе нековалентного комплекса с индуктором апоптоза является то, что, освободившись от первоначальной нагрузки, он может вносить внутрь раковой клетки и другие вещества. Показано, что АФП может связывать и транспортировать некоторые химиопрепараты. В составе такого комплекса цитостатик работает адресно и поэтому менее токсичен.
Однако, все эти работы до сих пор не привели к появлению нового таргетного (адресного) препарата на основе АФП. Одной из причин этого, как нам кажется, является нацеленность на искуственный (рекомбинантный) АФП. Известно, что в природе этот уникальный белок существует в нескольких модификациях. В зависимости от свойств среды, времени и способа выделения он может иметь совершенно разную пространственную структуру, от которой зависят его биологические свойства. Все попытки создать рекомбинантный АФП со свойствами, соответствующими природному белку, пока еще не привели к успеху. Второй причиной неудач, на наш взгляд, является стремление изготовить коньюгат, используя ковалентную (химическую) связь между АФП и целевым агентом. В этом случае АФП теряет свое основное преимущество — способность к многоразовому использованию. Приходится использовать его в высоких концентрациях, что резко повышает его иммуногенность. На такие коньюгаты организм начинает вырабатывать антитела, что полностью блокирует его работу.
Натуральные индукторы апоптоза на основе АФП безвредны и эффективны
В результате наших многолетних исследований было найдено несколько различных по своей природе и назначению нековалентных комплексов природного АФП с индукторами апоптоза. Некоторые из них были использованы или используются в исследованиях в качестве кандидатов на лекарственное применение.
В России запатентован Редуцин — инъекционый препарат на основе природного человеческого АФП в комплексе с природным антибиотиком Амфотерицином В.
В Канаде на стадии исследований находится Аимпила — пероральный препарат на основе природного свиного АФП и мощного природного индуктора апоптоза и тератогена, полученного из африканского растения «импила». Проведенные исследования in vitro и in vivo показали хорошую биодоступность капсульной формы препарата и его выраженное противометастатическое действие при разных типах рака. Аимпила безопасна и увеличивает продолжительность жизни онкобольных при сохранении качества.
Заслуживает дальнейшего изучения вопрос эффективности всасывания АФП в кишечнике после приема капсул. Возможно, что эффективное прохождение комплекса АФП-тератоген через стенки кишечника аналогично его прохождению через плаценту, о чем говорилось вначале.
Индуцирующие апоптоз препараты, подобные Редуцину и Аимпиле, должны стать незаменимыми участниками всех известных в настоящее время методов терапии рака, значительно повышая их эффективность.
Опубликованные патенты дают возможность производить и использовать передовые препараты для лечения рака.
Исчезновение метастазов в печени через восемь недель приема Аимпилы
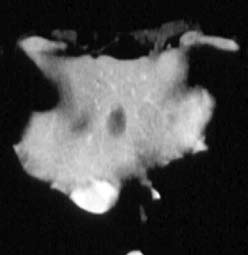 |
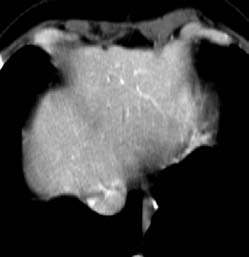 |
|
до |
после |













