Биомиметические нанотехнологии – молодое, стремительно развивающееся направление науки, в котором получение новых наноструктурированных материалов основано на воспроизведении или имитации принципов различных биологических процессов.
Федеральное государственное бюджетное учреждение науки Биолого-почвенный институт Дальневосточного отделения Российской академии наук, г. Владивосток:
|
Журавлев Ю.Н.,
директор, академик РАН;
|
Булгаков В.П.,
заведующий отделом биотехнологии, член-корреспондент РАН;
|
Шкрыль Ю.Н.,
ведущий научный сотрудник группы биоинженерии, к.б.н.;
|
Веремейчик Г.Н.,
старший научный сотрудник лаборатории биотехнологии,
к.б.н.;
|
Каменев Д.Г.,
аспирант группы
биоинженерии
|
Авраменко Т.В.,
студентка
|
Работа в данной области охватывает широкий спектр исследований, однако значительное место в них занимает изучение процесса биоминерализации у различных организмов [1]. Одним из частных примеров биоминерализации является формирование различных структур на основе кремнезема – биосилификация. Как правило, лабораторные способы получения разнообразных структур на основе кремния основаны на использовании экстремальных значений pH и температуры, тогда как в биологических объектах биосиликаты определенной формы образуются в условиях окружающей среды. Так, скелет губок построен из особых кремниевых образований – спикул. Формирование спикул основано на реакции поликонденсации кремниевой кислоты, катализируемой белками-силикатеинами [2]. Как нативные, так и рекомбинатные силикатеины губок обладают высокой способностью к поликонденсации различных соединений кремния (кремниевая кислота и ее соли, кремнийорганические производные) с образованием наноструктур в условиях in vitro [3]. Это свойство позволяет разрабатывать различные биомиметические технологии получения нанокремниевых структур с определенными характеристиками при обычных условиях. Кроме того, эти белки катализируют не только синтез силикатов, но также и полупроводниковых материалов на основе оксидов металлов TiO2, ZrO2, Ga2O3, способны вызывать образование наночастиц золота и биметаллических нанокристаллов фтортитаната бария [4]. С помощью силикатеинов можно получать нанотрубки, нановолокна или нанопленки как на основе кремнезема, так и других соединений [4].
В связи с высокой актуальностью исследований и разработок в области бионанотехнологий силикатеинов в 2007 г. в ДВО РАН под руководством академика Кульчина Ю.Н. (директор Института автоматики и процессов управления ДВО РАН) была создана научно-исследовательская группа, в состав которой вошли специалисты Биолого-почвенного института, Института автоматики и процессов управления, Тихоокеанского института биоорганической химии, Института химии. Основная работа группы направлена на создание биотехнологического источника рекомбинантного силикатеина и изучение способности полученных рекомбинантных белков синтезировать различные наноструктурированные материалы в условиях in vitro и in vivo.
На первом этапе работы необходимо было выделить гены силикатеинов, которые в дальнейшем можно было бы использовать для получения рекомбинантных белков. В работе по клонированию генов силикатеинов из обыкновенных морских губок нами было выделено в общей сложности 6 изоформ силикатеинов [5]. Масштабные и кропотливые поиски генов силикатеинов у стеклянных морских губок привели к обнаружению одной необычной изоформы силикатеина [6], первой полноразмерной последовательности у представителей этого класса. Из имеющихся в нашем распоряжении генов силикатеина для дальнейшей работы был выбран «классический» силикатеин обыкновенных губок, а также единственный ген, обнаруженный у стеклянных губок.
Создание возобновляемого и рентабельного источника действующего вещества имеет принципиальное значения для биотехнологического получения рекомбинантных белков. В качестве таких источников выступают различные про- и эукариотические экспрессионные системы. Нами созданы генетические конструкции для экспрессии рекомбинантного силикатеина в обоих типах экспрессионных систем. В первом случае используются такие экспрессионные векторы, как pQE и pET, при этом рекомбинантный силикатеин накапливается в клетках бактерий в нерастворимой и растворимой фракциях, соответственно.
В качестве эукариотической системы экспрессии были выбраны клетки растений табака Nicotiana tabacum. Трансгенные растения и культуры клеток табака в последнее время получили широкое распространение в качестве эффективного способа получения рекомбинантных белков [7]. Различные эукариотические белки, в том числе белки человека, проходят в клетках растений правильную посттрансляционную модификацию, сборку в надмолекулярные комплексы, то есть являются наиболее близкими к нативным. Это является важным фактором и для получения рекомбинатного силикатеина, поскольку его функциональная активность в губках определяется рядом посттрансляционных модификаций [8]. Для выделения рекомбинантного силикатеина из биомассы растительной ткани при помощи никель-аффинной хроматографии к последовательности силикатеина были пришиты гистидиновые аминокислотные таги. Кроме того, для изучения динамики накопления, локализации и других свойств рекомбинантного белка в трансгенных клетках ген силикатеина был сшит с последовательностью зеленого флуоресцентного белка – GFP. С помощью методов генной инженерии были получены трансгенные клеточные культуры (рис. 1а) и трансгенные растения (рис. 1б), экспрессирующие рекомбинантный силикатеин.

Рис. 1. Внешний вид трансгенной клеточной культуры (а) и трансгеного растения (b) табака, экспрессирующего ген силикатеина
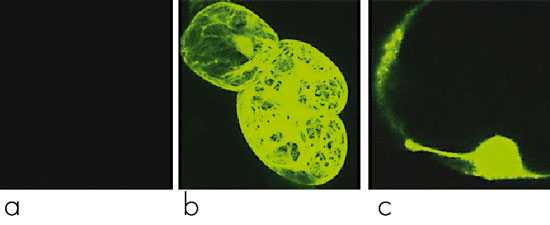
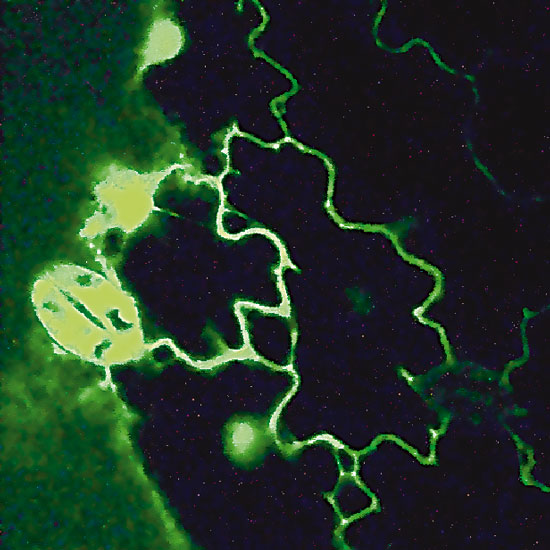
С помощью конфокальной микроскопии была установлена локализация силикатеина в трансгенных клетках табака (рис. 2, 3).
Рис. 2. Визуализация белка силикатеина, слитого с GFP, в трансгенных клеточных культурах табака: а – контрольная культура, b – флуоресценция GFP в клеточной культуре табака, c – флуоресценция силикатеина, слитого с GFP, в клеточной культуре табака
Рис. 3. Визуализация белка силикатеина, слитого с GFP, в трансгенных растениях табака
Использование растительной системы экспрессии является принципиально новой, не имеющей аналогов в мире, технологией получения рекомбинантного силикатеина.
В последние годы в качестве агентов, вызывающих образование наночастиц металлов, большое внимание исследователей привлекают растения и различные группы соединений из растений [9]. В научной литературе метод получения наночастиц металлов при помощи растений получил название фитосинтез. Нами была разработана технология получения наночастиц серебра, совмещающая метод фитосинтеза с уникальной способностью силикатеина к образованию наночастиц металлов. Наши результаты показывают, что при использовании экстракта контрольной (нетрансформированной) каллусной культуры табака происходит преимущественное формирование относительно крупных наночастиц (от 40 нм и больше), тогда как под действием экстракта трансгенной клеточной культуры, экспрессирующей ген силикатеина, образуются мелкие, 20-40 нм, частицы (рис. 4).

Рис. 4. Сканирующая электронная микроскопия наночастиц серебра, полученных методом фитосинтеза, с использованием контрольной клеточной культуры (а) и культуры, экспрессирующей ген силикатеина (b)
При этом эффективность фитосинтеза трансгенной культуры выше контрольной культуры в 2-3 раза. Предварительные данные показывают, что с помощью данного метода можно получать наночастицы не только серебра, но и золота, кобальта, меди, железа, цинка.
Актуальность исследования молекулярных механизмов, лежащих в основе биоминерализации, в настоящий момент не вызывает сомнений. Выявление и изучение главных биомолекул, отвечающих за биоминерализацию у различных организмов, является важной фундаментальной задачей. Кроме того, использование этих молекул или имитация принципа их действия лежит в основе получения новых биомиметических материалов и технологий.
Статья подготовлена при поддержке гранта Президента РФ МК-3459.2011.4
Литература
1. Ehrlich H. Biological materials of marine origin. Invertebrates // Biologically-inspired systems / Ed. Gorb S.N. Springer. P. 569.
2. Cha J.N., Shimizu K., Zhou Y., Christiansen S.C., Chmelka B.F., Stucky G.D., Morse D.E. Silicatein filaments and subunits from a marine sponge direct the polymerization of silica and silicones in vitro // Proc. Natl. Acad. Sci. USA. 1999. V. 96. P. 361-365.
3. Brutchey R.L., Morse D.E. Silicatein and the translation of its molecular mechanism of biosilicification into low temperature nanomaterial synthesis // Chem. Rev. 2008. V. 108. P. 4915-4934.
4. Schröder H.C., Schlossmacher U., Boreiko A., Natalio F., Baranowska M., Brandt D., Wang X., Tremel W., Wiens M., Müller W.E. Silicatein: nanobiotechnological and biomedical applications // Prog. Mol. Subcell. Biol. 2009. V. 47. P. 251-273.
5. Kozhemyako V.B., Veremeichik G.N., Shkryl Y.N., Kovalchuk S.N., Krasokhin V.B., Rasskazov V.A., Zhuravlev Y.N., Bulgakov V.P., Kulchin Y.N. Silicatein genes in spicule-forming and nonspicule-forming Pacific demosponges // Mar. Biotechnol. (NY). 2010. V. 12. P. 403-409.
6. Veremeichik G.N., Shkryl Y.N., Bulgakov VP, Shedko S.V., Kozhemyako V.B., Kovalchuk S.N., Krasokhin V.B., Zhuravlev Y.N., Kulchin Y.N. Occurrence of a silicatein gene in glass sponges (Hexactinellida: Porifera) // Mar. Biotechnol. (NY). 2011. V. 13. P. 810-819.
7. Tremblay R., Wang D., Jevnikar A.M., Ma S. Tobacco, a highly efficient green bioreactor for production of therapeutic proteins // Biotechnol. Adv. 2010. V. 28. P. 214-221.
8. Armirotti A., Damonte G., Pozzolini M., Mussino F., Cerrano C., Salis A., Benatti U., Giovine M. Primary structure and post-translational modifications of silicatein beta from the marine sponge Petrosia ficiformis (Poiret, 1789) // J. Proteome Res. 2009. V. 8. P. 3995-4004.
9. Sinha S., Pan I., Chanda P., Sen S.K. Nanoparticles fabrication using ambient biological resources // J. Appl. Biosci. 2009. V. 19. P. 1113-1130.